Nouveau réglement
Le règlement européen (UE) 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro (appelé « RDIV ») abroge la directive 98/79/CE et la décision 2010/227/UE de la Commission. Il vise à renforcer et harmoniser dans l’Union européenne l’ensemble de la réglementation relative aux dispositifs médicaux de diagnostic in vitro (DMDIV).
Le chapitre VI du RDIV est tout particulièrement dédié aux études des performances (EP) d’un DMDIV.
Les projets de recherche visant à évaluer un DMDIV et entrant dans le champ d’application du RDIV sont nommés « études des performances » (EP) et doivent se conformer aux dispositions du règlement à compter du 26 mai 2022.
Aussi, depuis le 26 mai 2022, la mise en œuvre des projets de recherches doit s’inscrire :
soit dans le cadre du RDIV, pour les études des performances entrant dans le champ d’application du Règlement (UE) 2017/746 ;
soit dans le cadre de la législation nationale relative aux collections d’échantillons biologiques, ou aux recherches impliquant la personne humaine (RIPH) (loi dite « Jardé »), pour les projets de recherche ne rentrant pas dans le champ d’application du RDIV.
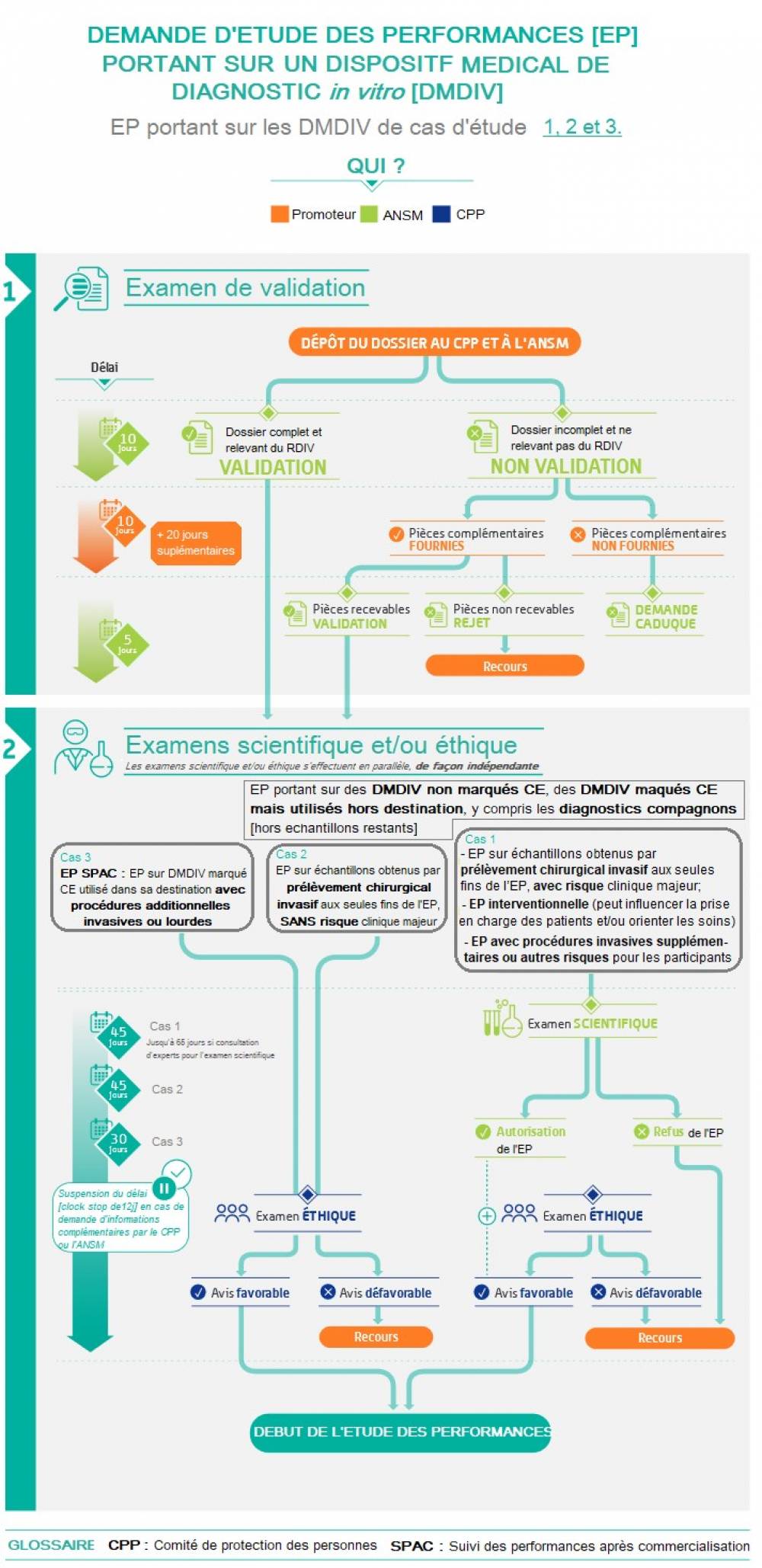
Le RDIV prévoit plusieurs cas d’EP notamment en fonction du risque pour le participant lié à l’étude, et en particulier au prélèvement de l’échantillon ou à un éventuel impact sur les décisions relatives à la prise en charge du participant, et selon que le DMDIV porte ou non le marquage CE.
A ces différents cas d’EP correspondent des procédures d’évaluation spécifiques. De façon générale, les EP régies par le RDIV font l’objet d’un examen scientifique et éthique (article 58.3 du RDIV) et ne peuvent être mises en œuvre en France que lorsqu’un avis favorable a été émis par un comité d’éthique (CPP) et le cas échéant, pour certaines EP, après autorisation de l’ANSM.
Le règlement prévoit le fonctionnement d'une base de données sous-tendant un certain nombre de fonctions connue sous le nom de «EUDAMED», dont certains modules, et notamment celui portant sur les EP, ne seront pas fonctionnels avant 2024.
Concernant la réglementation applicable aux recherches impliquant la personne humaine portant sur des DMDIV en cours ou soumises pour évaluation avant le 26 mai 2022, il convient de se référer à la Partie I de l’Avis aux promoteurs (cf. document 2 ci-dessous).
Le chapitre VI du RDIV est tout particulièrement dédié aux études des performances (EP) d’un DMDIV.
Les projets de recherche visant à évaluer un DMDIV et entrant dans le champ d’application du RDIV sont nommés « études des performances » (EP) et doivent se conformer aux dispositions du règlement à compter du 26 mai 2022.
Aussi, depuis le 26 mai 2022, la mise en œuvre des projets de recherches doit s’inscrire :
soit dans le cadre du RDIV, pour les études des performances entrant dans le champ d’application du Règlement (UE) 2017/746 ;
soit dans le cadre de la législation nationale relative aux collections d’échantillons biologiques, ou aux recherches impliquant la personne humaine (RIPH) (loi dite « Jardé »), pour les projets de recherche ne rentrant pas dans le champ d’application du RDIV.
Le RDIV prévoit plusieurs cas d’EP notamment en fonction du risque pour le participant lié à l’étude, et en particulier au prélèvement de l’échantillon ou à un éventuel impact sur les décisions relatives à la prise en charge du participant, et selon que le DMDIV porte ou non le marquage CE.
A ces différents cas d’EP correspondent des procédures d’évaluation spécifiques. De façon générale, les EP régies par le RDIV font l’objet d’un examen scientifique et éthique (article 58.3 du RDIV) et ne peuvent être mises en œuvre en France que lorsqu’un avis favorable a été émis par un comité d’éthique (CPP) et le cas échéant, pour certaines EP, après autorisation de l’ANSM.
Le règlement prévoit le fonctionnement d'une base de données sous-tendant un certain nombre de fonctions connue sous le nom de «EUDAMED», dont certains modules, et notamment celui portant sur les EP, ne seront pas fonctionnels avant 2024.
Concernant la réglementation applicable aux recherches impliquant la personne humaine portant sur des DMDIV en cours ou soumises pour évaluation avant le 26 mai 2022, il convient de se référer à la Partie I de l’Avis aux promoteurs (cf. document 2 ci-dessous).
![Cas de recherches dont les études des performances de DMDIV selon le règlement [UE] 2017/746 [RDIV] - Voie réglementaire](https://ansm.sante.fr/media/cache/block_slider/uploads/2022/07/08/20220706-ansm-infographie-dmdiv-voie-reglementaire-5.jpg)